Cadastre-se e receba grátis as principais notícias do Correio.
Secretário de saúde critica novas regras da Anvisa para uso da vacina
O órgão regulador alterou dois itens do guia
-
D
-
Da Redação
Publicado em 30 de dezembro de 2020 às 08:42
- Atualizado há 2 anos
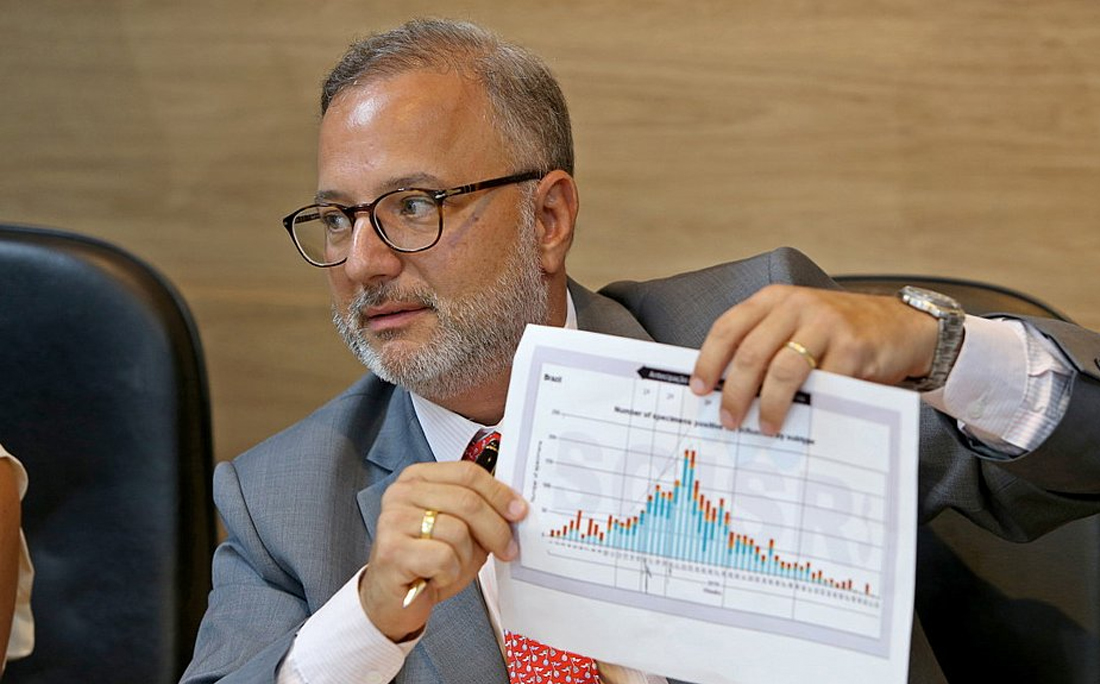
O secretário de Saúde da Bahia, Fábio Vilas-Boas, criticou a Agência Nacional de Vigilância Sanitária (Anvisa), que atualizou na terça-feira (29) o guia de uso emergencial de vacinas contra a covid-19. O documento trata dos requisitos mínimos para submeter a solicitação de autorização temporária para aplicar o imunizante no Brasil.
"É inconcebível e inaceitável pela sociedade à qual serve, a postura da @anvisa_oficial de manter as mesmas exigências regulatórias para aprovação das vacinas Covid19 em plena pandemia. Cada dia que passa sem vacina mais pessoas morrem!", criticou em seu perfil no Twitter.
"Minha crítica não possui qualquer conotação política. É pura indignação. Sou e sempre fui defensor da @anvisa_oficial e da sua blindagem. Mas o que estamos a viver é uma desconexão total da Agência com a realidade do mundo aqui fora. Exigir ensaios clínicos com alguns poucos milhares de brasileiros, quando lá fora já há dezenas de milhares estudados, pedir BPF e visitar o chão da fábrica da Pfizer americana (!), são alguns exemplos que me parecem exageros", completou o secretário.
O órgão regulador alterou dois itens do guia. Em um deles, retirou a obrigatoriedade de a empresa fornecer um cronograma de disponibilização da vacina ao País. Também não é mais necessário informar a quantidade de produto disponível, mas apenas uma previsão
Outro ponto modificado pela Anvisa trata do Termo de Consentimento Livre e Esclarecido (TCLE) que o paciente vacinado deve assinar. No novo texto, o governo sugere que seja utilizado o modelo adotado pelo Reino Unido ou outro desenvolvido pela empresa.
Na última segunda-feira, a farmacêutica Pfizer havia dito que não pretende submeter sua vacina contra o coronavírus para avaliação de uso emergencial no Brasil. Em nota, a empresa disse que o imunizante desenvolvido em parceria com a BioNTech seria apresentado em "processo de submissão contínua", o que acredita ser "o mais célere neste momento".
A Fundação Oswaldo Cruz (Fiocruz) também disse que não pedirá o uso emergencial do imunizante e tentará o registro definitivo. A fundação prevê entregar, no próximo ano, 210,4 milhões de doses da vacina desenvolvida pela Universidade de Oxford em parceria com a AstraZeneca.
O Instituto Butantã, que produz a Coronavac em parceria com a farmacêutica chinesa Sinovac, deve pedir tanto o registro emergencial quanto o definitivo à Anvisa.